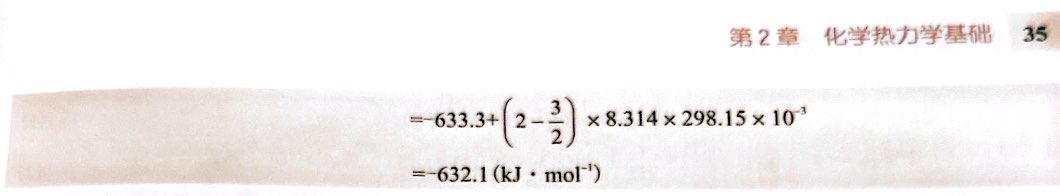第二章 化学热力学基础
基本概念
环境与体系
- 敞开体系:体系与环境间既有物质交换,又有能力交换
- 封闭体系:体系与环境间没有物质交换,只有能力交换
- 孤立体系:体系与环境之间既没有物质交换,也没有能力交换
状态和状态函数
状态:体系存在的某种状态
- 状态一定:状态函数一定
- 状态变化:状态函数也随之变化,与路径无关
由
广度性质和强度性质
广度性质
在数值上与体系中物质的量成正比,即具有加和性,例如:体积、质量、热力学能、焓、熵、自由能
强度性质
在数值上与体系中物质的量无关,即不具有加和性,例如:温度、压力、密度、浓度
总结:“量变”可以产生“质变”即为广度性质,由物质本身性质决定即为强度性质
过程和途径
- 定温过程
- 定压过程
- 定容过程
- 绝热过程
- 循环过程
热与功
热(heat)与功(work)是交换热量的两种方式
热量从高温物体传递到低温物体,为“热”,用
除此以外的其他方式,为“功”,用
按照热力学上的习惯:
- 体系吸热(体系内能量增加),
为正值;体系放热, 为负值 - 体系对环境做功(此时体系内能量减少),
为负值;环境对体系做功, 为正值
总结:体系内能量增加即为正,体系内能量减少即为负
热力学第一定律
能量守恒定律
体系的热力学改变量为:
热化学
反应进度
反应进度
可以表示为
其中,
误区:其中
PS:如何理解这些公式呢?其实可以将化学反应式变为数学方程式,即为:
在反应开始时,反应体系中的各物质的量为
其中
用到具体的方程式中,即为:
化学反应热
热化学中规定:只做体积功的化学反应体系,当反应物的温度和产物的温度相同时,吸收或释放出的热量称为化学反应热
体积功:在热化学中,体积功(也称为膨胀功)是指在化学反应过程中,由于气体体积的变化而做的功。具体来说,当气体在反应中膨胀或压缩时,会对外界做功或被外界做功,这种功称为体积功。
体积功的计算公式:
反应热一般是指反应进度
定容热
在密闭的容器内进行,反应体系的体积不变,
,体积功 也为零,此时体系的热力学能变化 其中
等于定热容,下标 表示体积不变,在只做体积功的条件下,定容反应热等于体系热力学能的改变量,即为 定压热
只做体积功,在定压条件下进行:
故:
由于
都为状态函数,所以 也是状态函数,热力学中定义一个新的状态函数焓,用符号 表示 故可得
在做体积功的条件下,定压反应热等于系统焓的改变量
定压热和定容热的关系
根据函数焓的定义
,故体系只做体积功时有: 由理想气体状态方程:
可得
对于有气体生成的反应,
不能被忽略 或者
下标
表示反应进度为 ; 为反应物和生成物中气相物质的计量数之和 热化学方程式
书写注意事项:
- 要注明反应物和产物的状态
- 注明反应物和生成物所处的温度和压力
- 反应多在定压下完成,用
表示反应热,负数表示放热,正数表示吸热 的意义是“标准状态下,反应进度 时的焓变” 或 的单位是 ,注意 代表一个过程的焓变,单位为 或
赫斯定律
一个反应在定压或定容条件下,不论是一步或者分几步完成,其反应热是相同的
标准摩尔生成焓
由元素的稳定单质生成
对于任何一个化学反应:
其中
标准摩尔燃烧焓
在一定温度及标准压力
熵
自发过程
- 自发过程具有方向性
- 自发过程存在限度
- 进行自发过程的体系具有做有用功(非体积功)的能力
混乱度和熵
混乱度
混乱度又称为无序度,它的大小与体系中可能存在的微观状态数目有关
熵
状态函数,用符号
表示
热力学第二定律
说明了自发过程中进行的方向和限度
标准熵
化学反应的熵变计算
在标准状态下,化学反应
可根据反应物和生成物的标准摩尔熵值求得:
自由能
自由能
定义:
自由能的变化量可求:
可通过自由能来判据反应是否能自发进行:
标准摩尔生成自由能
由稳定单质生成
在标准状态下,化学反应的吉布斯自由能改变量
吉布斯-亥姆霍兹方程
根据自由能定义
自由能的改变是