分光光度法
分析化学方法:
- 化学分析 原理:物质的化学反应
- 仪器分析 原理:物质的物理性质
物质对光的选择性吸收
- 吸收光谱:分子吸收光的能力后发生跃迁而产生的光谱
- 紫外-可见吸收光谱的产生是由于分子的外层电子能级跃迁
光吸收定律
Lambert-Beer定律(定量分析的基石)
- 透光率$$T={I_t\over{I_0}}\times{100%}$$
- 吸光率$$A=lg{I_0\over{I_t}}$$
- 透光率T与吸光率A和浓度的关系$$A=lg{1\over T}$$
- 朗伯定律:当用适当波长的单色光照射一固定浓度的均匀溶液时,A与b成正比(即液面厚度A与吸光度b之间成正比)
- 比尔定律:当用适当波长的单色光照射一固定的液面厚度的均匀溶液时,A与c成正比(即吸光度A与溶液浓度c成正比) 故可得出以下结论: 一束平行的单色光,通过均匀的、非散射的稀溶液时,溶液的吸光度与溶液的浓度和液面厚度的乘积成正比
- A:吸光度;描述溶液对光的吸收程度;
- k:摩尔吸光系数,单位
- b:液面厚度(光程长度),通常以
为单位 - c:溶液的摩尔浓度,单位
吸光系数和摩尔吸光系数
- 吸收系数
- 溶液的浓度单位为
时的吸收系数,用 表示: ,此时吸收系数在数值上等于溶液浓度为 ,b为 时的吸光度,单位为
- 溶液的浓度单位为
- 摩尔吸收系数
- 若溶液的浓度单位为
时的吸收系数,用 表示: ,此时吸收系数要用对于的摩尔来表示
- 若溶液的浓度单位为
- 摩尔吸收系数从实验测定计算:$$\epsilon={A\over{bc}}$$
- 吸收系数
桑德尔灵敏度
- 公式:$$S={M\over{\epsilon}}(\mu g / {cm}^2)$$ 其中: M:吸光物质的摩尔质量 S越小,表示测量的灵敏度越高
吸收曲线
建立全波段曲线的原因:
- 进行预实验,看看该物质在哪一个波段的吸收最强
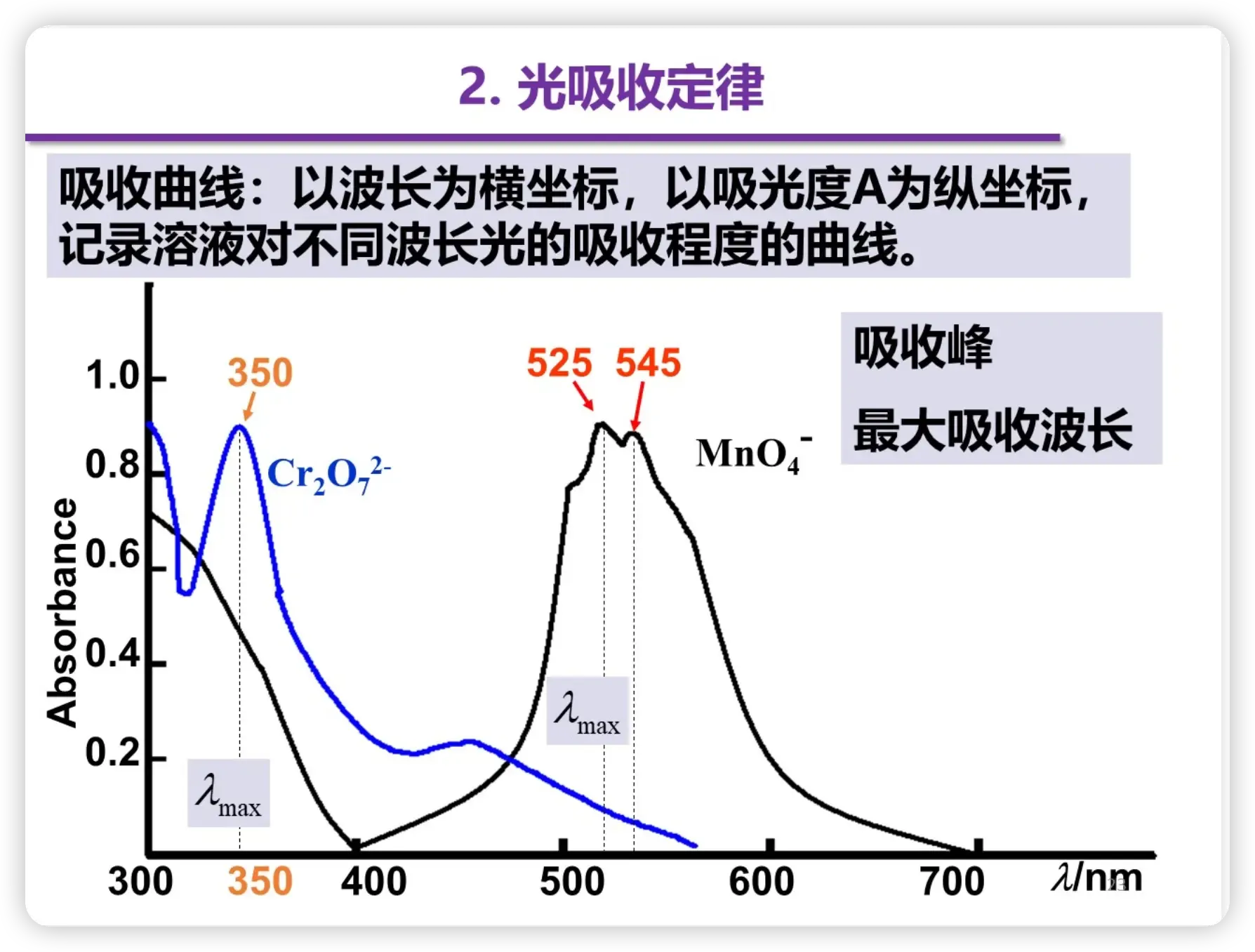
- 进行预实验,看看该物质在哪一个波段的吸收最强
吸收波段的特点
- 吸收光谱的性质时物质特有性质,与浓度无关(定性分析的基础)
- 吸光度的强度与物质的浓度成正比(定量分析基础)
- 最大吸光度所对于的波长为最大吸收波长,是与分子性质有关的重要参数,与浓度无关
分光光度计
- 基本部件
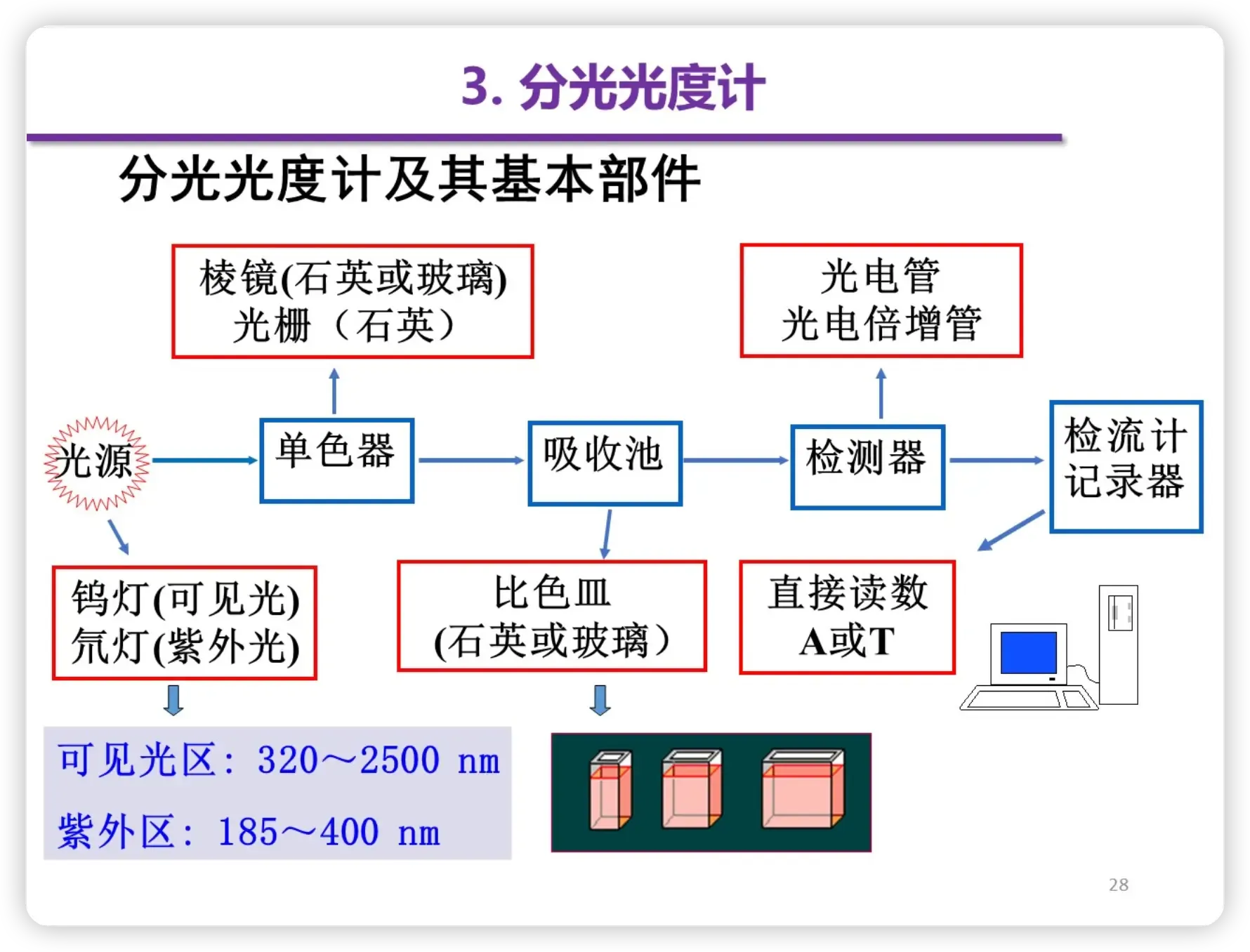
- 样品池(比色皿)
- 材质:玻璃比色皿——可见光区 石英比色皿——可见、紫外光区
- 一般操作过程

- 样品池(比色皿)
分光光度法的应用
吸光光度分析包括定性分析和定量分析
- 定性分析:扫描吸收光谱,确定最大吸收波长
- 定量分析:根据朗伯比尔定律进行
主要步骤如下: 1. 选择显色反应 2. 选择显色剂 3. 优化显色反应条件 4. 选择检测波长 5. 选择合适的浓度 6. 选择参比溶液 7. 建立标准曲线
显色反应
将无色或浅色的分子(离子)经化学反应转变为深色物质的反应,称之为显色反应 无机显色剂:硫氰酸盐、钼酸铵、过氧化氢 有机显色剂:双硫腙
显色条件的选择
- 选择合适的酸碱度,应当选择曲线中吸光度较大且恒定的平坦区对应的pH范围
- 显色剂应适当过量,以使反应完全
- 显色反应时间
- 显色反应温度
- 溶剂(一般采用水相测定)
共存离子消除的干扰
- 加入掩蔽剂
- 选择适当的显色反应条件
- 选择适当的测量条件
选择检测波长
选择原则:“吸收最大,干扰最小” 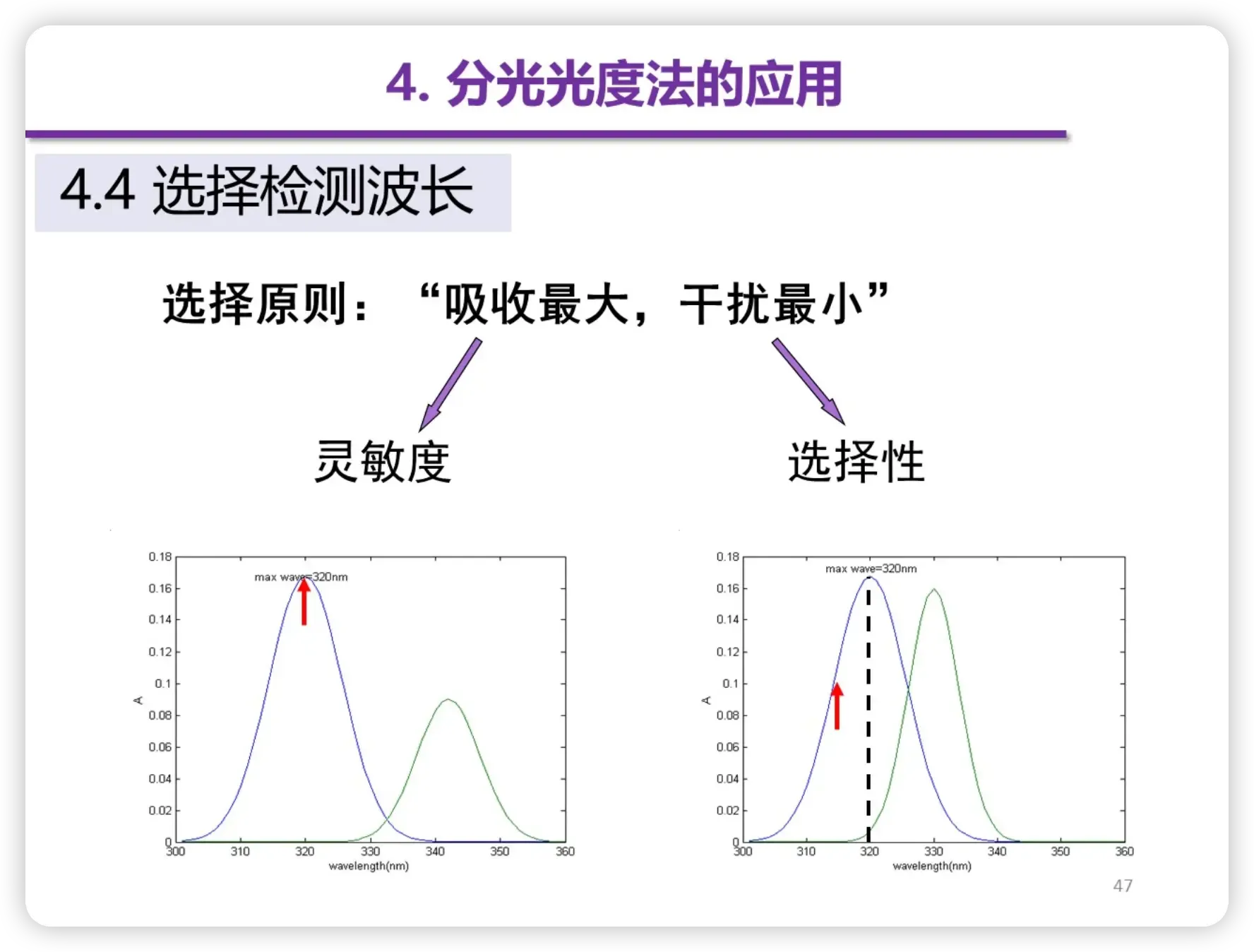
选择合适的浓度
控制浓度,减少测量误差
选择参比溶液
仪器调零;消除吸收池壁和溶液对入射光的反射;扣除干扰
- 参比溶液的类型和选择:
- 溶液参比
- 试剂参比
- 试液参比
建立标准曲线
配置一系列标准溶液,分别测量溶液的吸光度,以浓度为横坐标,吸光度为纵坐标,绘制的曲线称为标准曲线,为以通过原点的直线
![[分光光度法.png]]